El agua es el componente esencial de todo ser vivo, siendo además el disolvente (solvente) general biológico. Al mismo tiempo, es el medio en el que ocurren la inmensa mayoría de las reacciones celulares del metabolismo, siendo en definitiva la sustancia más necesaria para la vida. Los organismos vivos son por ello dependientes del agua para su existencia. Existe además una relación clara y directa entre el contenido de agua y la actividad fisiológica de un organismo. Junto con el mercurio, es el único mineral líquido del planeta.
Posee una importancia cuantitativa, ya que viene a representar el 75% del cuerpo de los seres vivos. Esta proporción varía de unas especies a otras y de unos tejidos a otros (hombre: 63% —de su peso—, algas: 95%, medusas: 98%, embrión humano: 94%, huesos: 22%, semillas: 20%, dientes: 10%,…). En los seres vivos se encuentra como:
- Agua circulante libre (ej.: en la sangre).
- Agua de inhibición (ej.: en el citoplasma).
- Agua combinada (es una forma no extraíble, aparece en reacciones químicas). El agua entra a los organismos con la bebida o con la comida y los organismos la pierden por transpiración (sudor), en las heces y en la orina. Es muy importante que los organismos mantengan la cantidad de agua que necesitan. Para ello, los organismos terrestres conservan la que tienen e ingieren más, mientras que los acuáticos necesitan expulsarla para evitar una cantidad excesiva dentro de sí.
Para comprender por qué el agua es tan extraordinaria y como, en consecuencia, puede desempeñar su papel único y central en relación con los sistemas vivos, debemos considerar en primer lugar su estructura molecular.
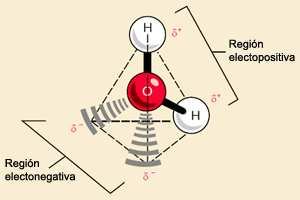
Cada molécula de agua está constituida por dos átomos de hidrógeno y un átomo de oxígeno. Cada uno de los átomos de hidrógeno está unido a un átomo de oxígeno por un enlace covalente, o sea, el electrón único de cada átomo de hidrógeno es compartido por el átomo de oxígeno, que también contribuye con un electrón para cada enlace. La molécula de agua, en conjunto, es pues, de carga neutra ya que tiene igual número de electrones y protones. Sin embargo, es una molécula polar, a raíz de la atracción muy fuerte que ejerce el átomo de oxígeno por los electrones, los electrones compartidos de los enlaces pasan más tiempo alrededor del núcleo de oxígeno que el que pasan alrededor de los núcleos de hidrógeno. En consecuencia, la región que se encuentra cerca de cada núcleo de hidrógeno es una zona débilmente positiva.
Más aún el átomo de oxígeno tiene cuatro electrones adicionales en su nivel energético exterior. Estos electrones estarán pareados en dos orbitales que no están implicados en el enlace covalente con el hidrógeno. Cada uno de estos orbitales es una zona débilmente negativa. Así, la molécula de agua, desde el punto de vista de la polaridad, tiene cuatro esquinas, dos esquinas cargadas positivamente y otras dos cargadas negativamente. Cuando una de estas regiones cargadas se aproxima a la región de carga opuesta de otra molécula de agua, la fuerza de atracción provoca que se forme un enlace que se conoce como puente de hidrógeno.
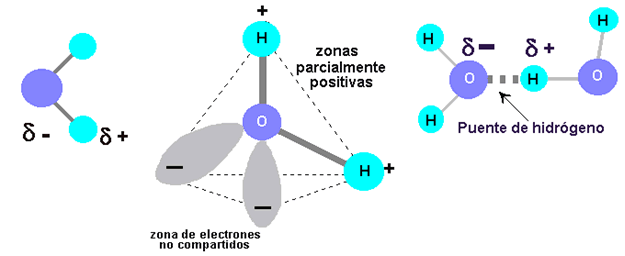
Los puentes de hidrógeno se encuentran no sólo en el agua, sino también en muchas otras moléculas grandes, en las que tienden a mantener la estabilidad estructural. Sin embargo, son muy específicos. Un puente hidrógeno puede formarse solamente entre un átomo de hidrógeno que forma parte de un enlace covalente y un átomo que posee fuerte atracción por los electrones. En las moléculas que se encuentran en los sistemas vivos, los puentes de hidrógeno ocurren típicamente entre un átomo de hidrógeno que tiene un enlace covalente y un átomo de oxígeno o nitrógeno de otra molécula.
Cualquier puente de hidrógeno simple es significativamente más débil que un enlace covalente o iónico. Más aún, tiene una vida extraordinariamente corta; en promedio, cada puente de hidrógeno en el agua líquida dura en 100.000 millonésimo de segundo. Pero cuando un puente hidrógeno se rompe, otro se forma. En conjunto, los puentes de hidrógeno tienen una fuerza considerable y hacen que las moléculas de agua se aferren estrechamente como un líquido, bajo condiciones ordinarias de temperatura y presión. Como consecuencia de la formación de puentes de hidrógeno entre las moléculas de agua, el agua tiene una serie de propiedades muy importantes:
a) Tensión superficial. Fenómenos como la adherencia de una gota de agua al borde de una canilla son debidos a la tensión superficial del agua. La tensión superficial es el resultado de la cohesión o la atracción mutua de las moléculas de agua, pues bien, el agua, a causa de sus cargas positivas y negativas es capaz de establecer interacciones entre estas moléculas permitiendo su adhesión a todo tipo de materiales.
b) Acción capilar e inhibición. Si se mantiene dos láminas de vidrio juntas y se sumerge un extremo en agua, la combinación de la cohesión y la adhesión hace que el agua ascienda entre las dos láminas. Esto es la acción capilar. De igual modo, la acción capilar hace que el agua suba por tubos de vidrio muy finos, que ascienda en un papel secante, o que atraviese lentamente los pequeños espacios entre las partículas del suelo y, de esta manera, esté disponible para las raíces de las plantas. La inhibición es la penetración capilar de moléculas de agua en sustancias tales como la madera o la gelatina, que se hinchan como resultado de ello, así por ejemplo, las semillas se embeben de agua cuando comienzan a germinar, hinchándose y reventando sus tegumentos.
c) Resistencia a los cambios de temperatura. Para aumentar la temperatura del agua se requiere un mayor consumo de energía que para aumentar la temperatura del aire. La cantidad de calor que requiere una cantidad dada de sustancia para que se produzca un aumento de un grado de temperatura, es lo que se define como calor específico. Este calor especificó del agua es aproximadamente el doble del aceite o del alcohol. El alto calor específico del agua es una consecuencia de los puentes de hidrógeno. Los puentes de hidrógeno del agua restringen el movimiento de las moléculas. Para que la energía cinética de las moléculas de agua aumente suficientemente como para elevar la temperatura de está un grado, primero es necesario romper cierto numero de puentes de hidrógeno que mantienen juntas las moléculas.
Dado que se necesita mucho ingreso o pérdida de calor para subir o bajar la temperatura del agua, los organismos que viven en los océanos o grandes masas de agua dulce viven en un ambiente en el que la temperatura era relativamente constante. Asimismo, el alto contenido de agua de las plantas y animales terrestres les permite mantener una temperatura interna relativamente constante. Esta constancia de temperatura es crítica, porque las reacciones químicas biológicamente importantes tienen lugar sólo dentro de una gama estrecha de temperatura.
d) Vaporización. La vaporización, o evaporación como se la llama más comúnmente, es el cambio de un líquido a un gas. El agua tiene un alto calor de vaporización. El punto de ebullición del agua es de unos 100 grados centígrados a una presión de una atmósfera, es decir, se necesitan 540 calorías para convertir 1 g de agua líquida a vapor, casi 60 veces más que lo necesario para el éter y el doble que lo necesario para el amoniaco. Los puentes de hidrógeno son también responsables del alto calor de evaporación del agua. La vaporización ocurre porque parte de las moléculas que se mueven muy rápidamente en un líquido abandona su superficie y entran en el aire. Para que una molécula de agua se separe de las moléculas vecinas, o sea, para que se vaporice, deben romperse los puentes de hidrógeno. Esto requiere energía térmica. En consecuencia, cuando el agua se vapora, ya sea de la superficie de la piel o de una hoja, las moléculas que escapan llevan consigo una gran cantidad de calor. Así, que la vaporización tiene efecto refrigerador. La evaporación desde la superficie de una planta o de un animal terrestre es uno de los principales medios por los cuales estos organismos descargan el exceso de calor y estabilizan sus temperaturas.
e) Punto de fusión. Otra peculiaridad que muestra el agua se puede observar durante su transición de estado líquido a sólido. En la mayoría de los líquidos, la densidad, o sea, el peso del material en un volumen dado, aumenta a medida que la temperatura cae. Esta mayor densidad ocurre porque las moléculas individuales se mueven más lentamente y, por tanto, los espacios entre ellas disminuyen. La densidad del agua también aumenta a medida que la temperatura cae, hasta que se acerca a los 4 grados centígrados. Luego las moléculas de agua se aproximan tanto y se mueven tan lentamente que cada una de ellas puede formar puentes de hidrógeno simultáneamente con otras cuatro moléculas, algo que no pueden hacer a temperaturas más altas. Así, el agua en estado sólido ocupa más volumen que el agua en estado líquido. El hielo es menos denso que el agua liquida y, por tanto, flota en ella. Así, la capa de hielo que se puede observar en los lagos aísla eficientemente el agua liquida que se encuentra por debajo de él, manteniendo la temperatura de esta última en el punto de congelación o por encima de él. La presencia de sustancias disueltas en el agua disminuye el punto de congelación, razón por la cual muchas especies de plantas resisten temperaturas muy frías ya que producen la degradación de almidón en azúcares simples que son solubles.
«Eppur si mouve«. Galileo Galilei
Ad orbis per scientiam