La estructura final de una proteína se consigue por un proceso muy complejo, de modo que procederemos a la descripción de algunos puntos sencillos sobre los que se asienta este mecanismo:
- ESTRUCTURA PRIMARIA
Queda determinada por la composición de aminoácidos de la proteína y la secuencia en que se disponen. La secuencia de αα viene determinada genéticamente y de ella dependen los demás niveles estructurales, al poder establecer un plegamiento tridimensional específico.
- ESTRUCTURA SECUNDARIA
Se trata de patrones de plegamiento regulares habituales de la cadena polipeptídica y se debe a la capacidad de rotación que tienen los enlaces que forman el Cα de cada aminoácido. Los tres más frecuentes son:
La hélice-α. Cadena de aminoácidos con las siguientes características
- Es una hélice dextrógira, ocurriendo los giros a nivel de Cα de cada aminoácido.
- Se establecen enlaces entre grupos NH y grupos CO de enlaces peptídicos diferentes que, debido al enrollamiento, se encuentran enfrentados.
- Cada vuelta de hélice consta de 3.6 aminoácidos
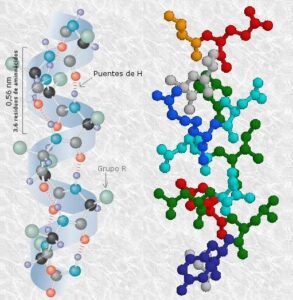
La formación de esta estructura es energéticamente muy favorable porque permite una disposición óptima de los puentes de hidrógeno intracatenarios. Su estabilidad se ve afectada por la presencia de muchos residuos consecutivos con la misma carga o por la coincidencia de varios residuos de prolina que presentan una restricción conformacional.
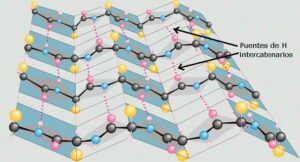
- La lámina-β
Se trata de una estructura en forma de zig-zag en la que las diferentes cadenas polipeptídicas se disponen de forma adyacente formando una lámina. Los fragmentos que conforman esta lámina pueden ser antiparalelos o paralelos y pueden pertenecer a la misma o a distintas cadenas polipeptídicas. Se estabiliza mediante enlaces por puentes de H entre átomos del enlace peptídico (grupos NH y CO), que se forman entre dos cadenas laterales diferentes. Las cadenas laterales se encuentran situadas tanto por debajo como por encima del plano en zig-zag de la hoja plegada.
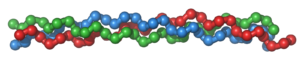
- La triple hélice de colágeno
En su composición abundan la prolina y la hidroxiprolina, que no forman puentes de H. Se trata de una estructura formada por tres cadenas. Cada una de ellas es una hélice levógira de 3 residuos por vuelta. Las tres cadenas, una vez plegadas, sufren un superenrollamiento dextrógiro.
- ESTRUCTURA TERCIARIA
Este nivel estructural se refiere a la disposición tridimensional final de una única cadena polipeptídica que se mantiene gracias a diferentes enlaces que se mantienen entre los restos de los aa que forman la cadena peptídica. Puede incluir elementos de estructura secundaria o participar en ellos, al igual que puede incluir o componer protein motifs.
Esta configuración tridimensional se denomina conformación, existiendo conformaciones de dos tipos:
- Globular: La estructura secundaria se pliega y adopta una forma tridimensional compacta más o menos esférica como es el caso de la mioglobina.
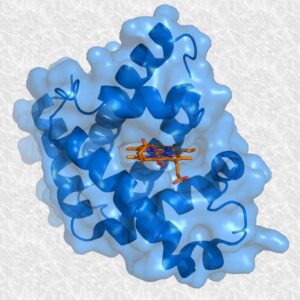
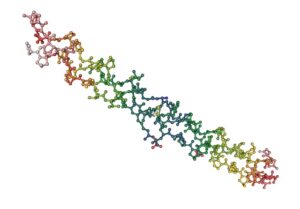
- Fibrosa: La estructura secundaria no se pliega; por tanto, la proteína tiene forma alargada como por ejemplo, la fibroína de la seda o el colágeno.
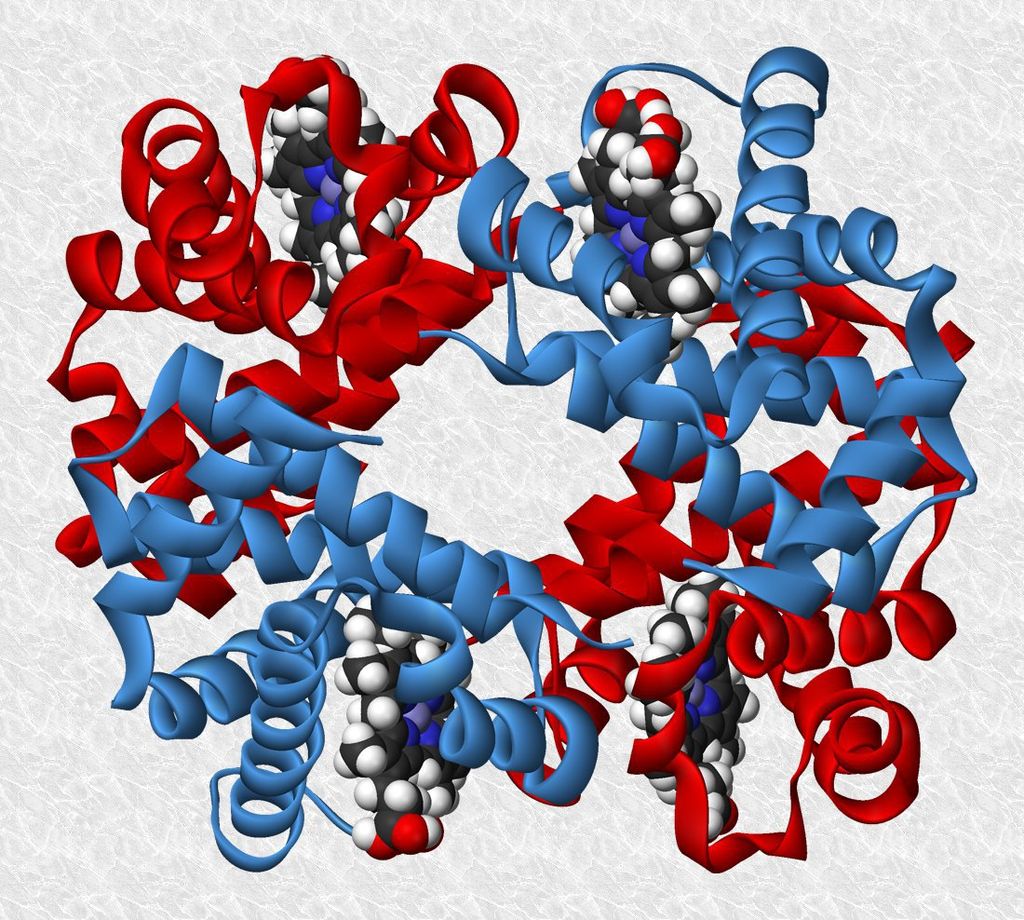
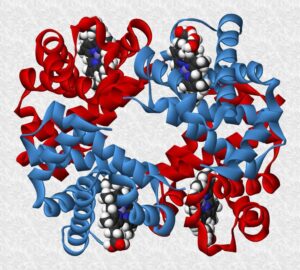
- ESTRUCTURA CUATERNARIA
Es la combinación de diferentes cadenas polipeptídicas (protómeros) para dar lugar a una proteína oligomérica. Un ejemplo clásico de estructura cuaternaria lo encontramos en la hemoglobina, de 4 cadenas (2 cadenas a y 2 cadenas b) que se mantienen unidas gracias a interacciones de tipo débil entre αα pertenecientes a distintas cadenas.
¿CÓMO ADQUIEREN LAS PROTEÍNAS EL PLEGAMIENTO?
Una idea que ha tenido particular relieve en este campo es el modelo del embudo de energía libre (“free energy folding funnel”). A grandes rasgos, se propone que, a medida que la proteína adopta su plegamiento, nunca deshace el camino andado si esto supone aumentar su energía interna. En cualquier caso, la respuesta a esta pregunta es conocida con el nombre de paradoja de Levinthal y se trata de una de las principales cuestiones de la bioquímica actual que no está en absoluto resuelta de una forma completa.
Nos encontramos en los comienzos mismos de la era de la raza humana. No es ilógico que tengamos o que tropecemos con problemas, pero hay decenas de miles de años en el futuro. Es responsabilidad nuestra hacer lo que podamos, aprender lo que podamos, mejorar las soluciones y transmitirlas a nuestros sucesores. Es responsabilidad nuestra dejar las manos libres a las generaciones futuras. Richard P. Feynman
Ad orbis per scientiam