A lo largo de la historia de la ciencia diferentes científicos han presentados sus ideas de como estaba organizada la materia, siendo estos modelos más o menos acertados. Lo que exponemos ahora es una aproximación a dichos modelos para que te sirva como base para preparar tu futuro examen.
En el S. IV A.C. Leucipo y Demócrito formularon el primer modelo atómico en el que afirmaban que la materia no podía ser dividida de forma infinita y esa porción que ya no podía ser dividida se le llamo átomo, que quiere decir indivisible.
En 1808 Dalton publicó su modelo atómico que se basaba en el modelo anterior, lo que ser convertiría en una tónica, y que afirmaba entre otros postulados que la materia esta formada por átomos indivisibles además de ser invariables.
También afirmaba que átomos de un mismo elemento tienen la misma masa y las mismas propiedades mientras que átomos de diferentes elementos tienen diferente masa y diferentes propiedades. Que los compuestos están formados por la combinación de dos o más elementos y que estos lo hacen en una relación de números enteros.
En 1898 Thomson dio a conocer su modelos atómico que ya se basaba en el conocimiento previo de la existencia de las partículas atómicas: protones, neutrones y electrones. Thomson postulaba que de un átomo sólo se pueden extraer los electrones.
El modelo se basaba en una masa esférica cargada positivamente donde se encontraban incrustados los electrones haciendo que el átomos fuese electricamente neutro.
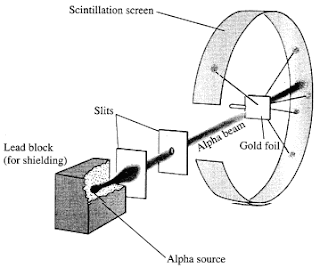
Más adelante en 1911, Rurtherford publicó su modelo atómico basándose en la siguiente experiencia:
Rurtherford bombardeo una lámina de oro con partículas alfa procedentes de un material radiactivo, tras el material situó una lámina sensible a las partículas alfa (ver dibujo). Rutherford observó que la mayoría de las partículas atravesaban la lámina de oro mientras que otras rebotaban. De las que atravesaban la lámina algunas pasaban rectas y muchas desviadas.
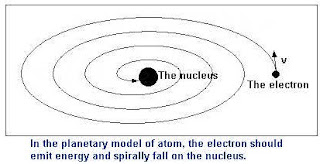
Basándose en esto Rurtherford postulo que el átomo está formado por un núcleo central pequeño, cargado positivamente y que concentra casi toda la masa del átomo y una corteza inmensa comparada con el núcleo donde giran los electrones y está cargada negativamente. El problema de este modelo es que los electrones al girar alrededor del núcleo van perdiendo energía con lo que caerían sobre el núcleo destruyendose la matería, cosa que obviamente no ocurre.
En 1913 Bohr propuso su modelo atómico que se basaba en el Rurtherford pero situaba los electrones en niveles con diferentes niveles energéticos, los niveles son más energéticos cuanto más alejados se encuentran del núcleo y el paso de un nivel a otro supone la absorción o emisión de un cuanto o fotón de luz.
El modelo atómico actual fue desarrollado por Schrödinger y Heisenberg en la década de los años 20 del siglo pasado y sustituía las orbitas por orbitales que es donde existe probabilidad de encontrar un electrón. Existen varios subniveles: s, p,d y f, existiendo diferentes orbitales en cada uno de ellos y teniendo diferentes formas geométricas.