En estado neutro todos los átomos diferentes del átomo de hidrógeno poseen más de un electrón, el átomo de helio posee 2 electrones, el de litio tres electrones, y en general un átomo de un elemento con un número atómico Z tendrá Z electrones. En sí, una configuración electrónica, representa la organización de los electrones
Estos electrones van llenando los diferentes orbitales de un átomo multielectrónico, para ellos debemos plantearnos los orbitales de la siguiente forma: el orbital s está formado por una caja donde caben sólo 2 electrones, el orbital p por tres cajas en las que caben dos electrones en cada una, el orbital d tiene 5 cajas y así consecutivamente…
La razón por la que sólo hay dos electrones en cada caja es por el principio de exclusión de Pauli que afirma que sólo dos electrones como máximo pueden ocupar un orbital dado, y cuando dos electrones ocupan un orbital sus espines deben estar apareados.
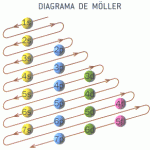
Para no perdemos a la hora de de realizar la configuración electrónica utilizamos el siguiente diagrama de Möller:
La razón por la que sólo hay dos electrones en cada caja es por el principio de exclusión de Pauli que afirma que sólo dos electrones como máximo pueden ocupar un orbital dado, y cuando dos electrones ocupan un orbital sus espines deben estar apareados.
En cada uno de esto orbitales debemos tener en cuenta que sólo pouden contener un número fijo de electrones para ello realizares las configuración electrónica siguiendo este criterio:
- Nivel s: 2 electrones
- Nivel p: 6 electrones
- Nivel d: 10 electrones
- Nivel f: 14 electrones
Por ejemplo la configuración electrónica del fósforo sería 1s2 2s2 2p6 3s2 3p3
Con la configuración electrónica podemos saber a que periodo corresponde un determinado elemento, para ello debemos de saber primero los bloques de la tabla periódica.
Como podemos observar en el diagrama, dependiendo cual es el último orbital en el que nuestro elemento coloque electrones, podremos determinar en que periodo se encuentra, si tomamos de nuevo el fósforo y observamos su configuración electrónica, podemos observar que pertenece al periodo 3
P: 1s2 2s2 2p6 3s2 3p3
Ad orbis per scientiam