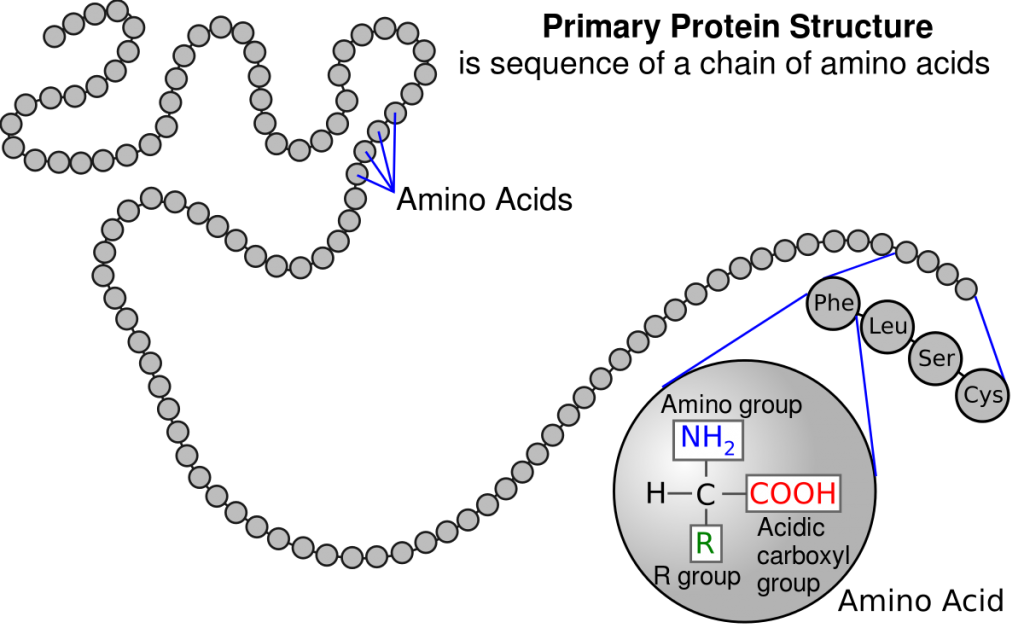
La estructura primaria de una proteína es la secuencia lineal de los residuos de aminoácidos. Al escribir las estructuras primarias se emplean los códigos de tres y de una letra de dichos aminoácidos. Los términos dipéptido, tripéptido, péptido, oligopéptido y polipéptido se utilizan para indicar la longitud de la cadena. Así aquellas que tengan dos residuos de aminoácidos se denominan dipéptidos; las de tres, tripéptidos; las que contengan menos de 50 residuos se llaman péptidos o bien oligopéptidos; por último, las cadenas más largas se llaman polipéptidos.
La estructura secundaria es la conformación que se repite de forma regular en la cadena polipeptídica. Consideraremos detalladamente dos tipos de estructura secundaria que poseen elementos que se repiten de forma regular en la cadena polipeptídica, la hélice alfa y la lámina beta plegada.
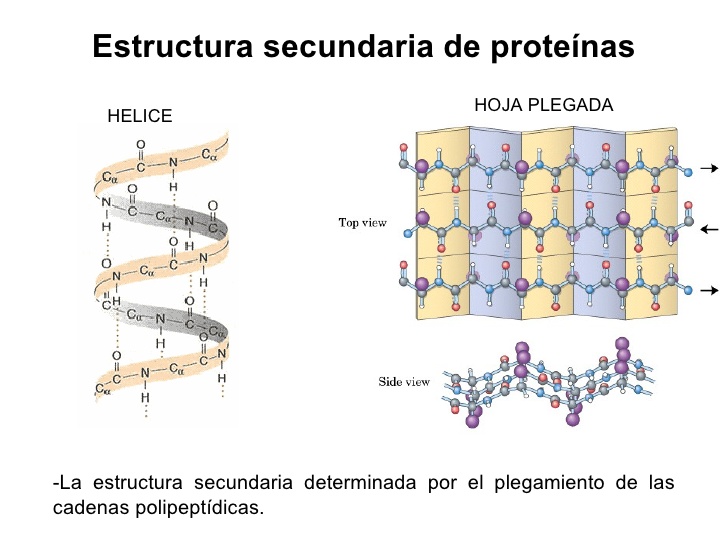
Las hélices a pueden ser tanto dextrógiras como levógiras. En general es más estable la hélice a dextrógira compuesta por L-aminoácidos, ya que en la hélice a levógira van a aparecer repulsiones estéricas entre los grupos C=O y las cadenas laterales. Además, la hélice a dextrógira es la única que se ha encontrado en las estructuras de las proteínas.
En una hélice a, todos los oxígenos carbonílicos del esqueleto polipeptídico están unidos, mediante enlaces de hidrógeno, a los átomos de hidrógeno de los grupos amídicos de la cadena que están alejados tres residuos. Estos enlaces de hidrógeno son casi paralelos al eje longitudinal de la hélice, estando los átomos de nitrógeno; hidrógeno y oxígeno que forman dicho enlace prácticamente alineados. Se requieren 3,6 residuos para dar una vuelta de hélice completa,. siendo el alcance longitudinal de cada residuo de 0.15 nm. Cada 0.54 nm se repiten posiciones equivalentes, denominándose a esta distancia vuelta de la hélice.
Algunos aminoácidos tienen mayor tendencia que otros a aparecer en las hélices a. Este es el caso de los residuos pequeños o no cargados como la alanina, la leucina y la fenilalanina. Los residuos más polares, como la arginina, el glutamato y la serina, tienden a repelerse y a desestabilizar la hélice, teniendo por ello menor tendencia a encontrarse en las hélices a. La prolina no aparece nunca en la hélice a porque su anillo de pirrolidina no puede asumir la conformación necesaria.
Un grupo de proteínas fibrosas que se encuentra casi completamente estructurado en hélice a es el conocido como a-queratinas. En la mayoría de los vertebrados, estas proteínas son los componentes mayoritarios del pelo, la piel, las uñas y los picos de las aves. La unidad estructural básica de las a-queratinas es una estructura formada por cuatro hebras denominada protofibrilla. Estas protofibrillas están constituidas por dos hélices, cada una de dos hebras, enrollada la una sobre la otra de forma levógira para formar una espiral conocida como hélice superenrollada o superhélice. Cada hélice está compuesta por dos hélices a dextrógiras que contienen algunas regiones no helicoidales. La hélice superenrollada se estabiliza por interacciones de Van der Waals entre las cadenas laterales apolares, estrechamente empaquetadas, y por entrecruzamientos mediante puentes disulfuro entre las cadenas peptídicas. Estas protofibrillas se disponen en estructuras superiores, llamadas microfibrillas, consistentes en la asociación de ocho protofibrillas dispuestas en forma de circulo. A semejanza de las protofibrillas, las microfibrillas están entrecruzadas por formación de puentes disulfuro. El número de estos enlaces va a determinar la rigidez de la fibra. Así, las queratinas con pocos entrecruzamientos del tipo disulfuro, como las. que se encuentran en la lana, son suaves, flexibles y se alargan con facilidad. En cambio, las queratinas con un elevado número de puentes disulfuro, como las de las uñas y los picos de las aves, son duras, rígidas, no flexibles y no se pueden estirar fácilmente.
En algunos tipos de proteínas fibrosas, las cadenas que las constituyen aparecen casi completamente extendidas en vez de enroscadas. En estas proteínas, los oxígenos carbonílicos y los hidrógenos amídicos se encuentran casi perpendiculares al eje longitudinal de la cadena extendida. Cuando se forman los enlaces de hidrógeno entre los oxígenos carbonílicos y los hidrógenos amídicos de dos o más cadenas polipeptídicas extendidas y adyacentes aparece un tipo de conformación denominado lámina b. Esta estructura no es completamente plana, sino que presenta un ligero plegamiento debido a los ángulos de los enlaces que forman las cadenas polipeptídicas. Las cadenas adyacentes que forman la lámina b pueden ser paralelas o antiparalelas, según qué los enlaces peptídicos de las distintas cadenas avancen en el mismo o en distinto sentido. En ambos tipos de láminas, las cadenas laterales de los residuos consecutivos se encuentran, en lados opuestos de la lámina. Esta propiedad es particularmente importante en la estructura de la fibroína de la seda, una proteína producida por el gusano de seda, Bombyx mori. La estructura secundaria de la fibroína de la seda está basada en unas cadenas polipeptídicas que se disponen formando láminas antiparalelas. La estructura primaria de esta proteína está formada por la repetición de la siguiente secuencia de aminoácidos (Ser-Gly-Ala-Gly). Esta secuencia alternada conduce a que los hidrógenos del carbono a de la glicocola se sitúen a un lado de la lámina y los grupos metilo de la alanina y los grupos CH2OH de la serina, del lado contrario. La fibroína de la seda es flexible debido a que las laminas apiladas se mantienen unidas por interacciones de Van der Waals entre las cadenas laterales de los aminoácidos de cada lamina. La resistencia de la fibra viene dada por el amplio número de enlaces de hidrógeno entre las cadenas adyacentes y el efecto acumulativo de las interacciones de Van der Waals entre las laminas apiladas.
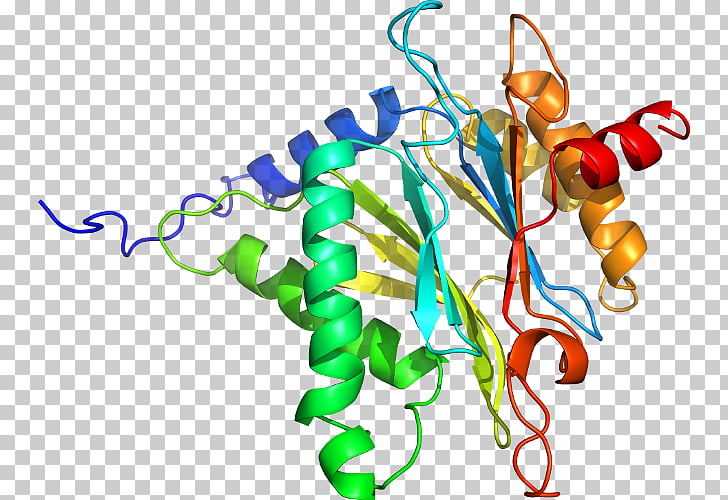
La estructura terciaria de una proteína consiste en su conformación tridimensional activa biológicamente, o nativa. La característica más relevante de este tipo de estructura es el plegamiento distante en el cual residuos muy alejados en la secuencia primaria van a aparecer juntos. Esta estructura es típica de proteínas globulares, o proteínas con forma esférica y donde no predomina ninguno de los tres ejes espaciales. En dichas proteínas globulares que son además extracelulares, este plegamiento lejano aparece algunas veces estabilizado por puentes disulfuro, que se forman después de que se consiga la conformación nativa definitiva. La estructura terciaria de las proteínas, especialmente de aquellas de elevado peso molecular con más de 200 residuos, está constituida por varios dominios, o unidades compactas conectadas a través del esqueleto polipeptídico. El plegamiento de la cadena polipeptídica dentro de un determinado dominio suele transcurrir de forma independiente a la de los otros dominios.
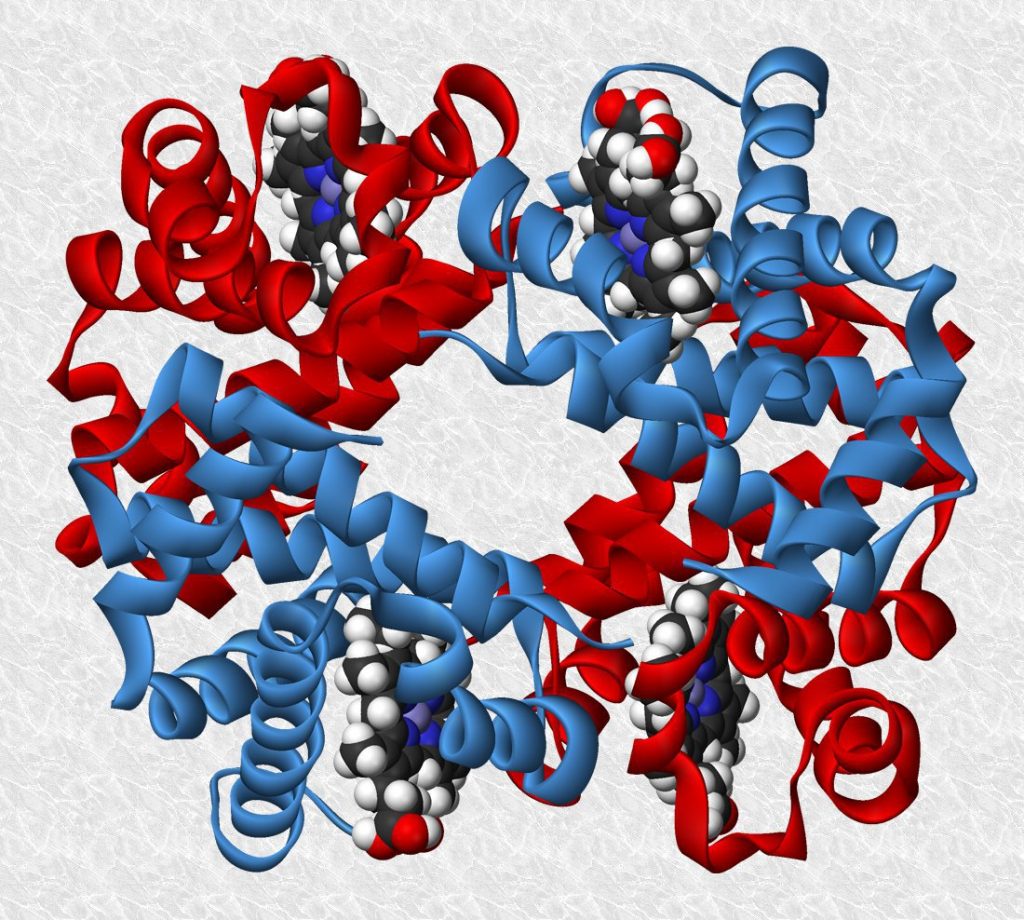
La estructura cuaternaria de una proteína hace referencia al ensamblaje de dos o más cadenas polipeptídicas separadas, que se unen mediante interacciones no covalentes o por entrecruzamientos covalentes. El conjunto suele denominarse oligómero y sus cadenas peptídicas constituyentes, monómeros o subunidades. Los monómeros de una proteína oligomérica pueden ser idénticos o distintos en sus estructuras primaria, secundaria y terciaria. La mayoría de las proteínas globulares intracelulares suelen tener múltiples cadenas lo que no ocurre en las proteínas secretadas.
Un científico debe tomarse la libertad de plantear cualquier cuestión, de dudar de cualquier afirmación, de corregir errores. Robert Oppenheimer(1904-1967) Físico estadounidense.
Ad orbis per scientiam