Uno de los problemas a los que se enfrentan los seres vivos en su medio interno es al mantenimiento de los valores de pH dentro de un rango contaste ya que este podría sufrir variaciones constantes debido a los productos finales que se producen en las reacciones o rutas metabólicas.
Para ello, los seres vivos tienes dos sistemas para hacerlo:
- Las disoluciones amortiguadoras o tampón
- La eliminación de estos metabolitos a través de la respiración y la excreción
El más interesante y que desarrollaremos es el de las disoluciones amortiguadoras que actúan como primera línea de acción ante estas variaciones y mantener de esta forma un valor constante de pH. En los seres humanos el pH, según funciones vitales oscila entre 6,8 y 7,8, siendo el valor normal el que se sitúa en el intervalo de 7,35 a 7,45.
Como podemos ver este margen de pH es muy estrecho y para poder mantenerlo en cuando entran en acción las disoluciones amortiguadoras que son capaces de resistir tanto la adicción de ácidos como bases. Entre las diferentes disoluciones las más destacables son la del tampón carbonato-bicarbonato y el tampón fosfato.
Una solución tampón está formada por un ácido débil (en disolución) y su base conjugada. Esto permite que cuando a una disolución le añadimos H+ o de OH– no se produzcan cambios importantes de pH, siendo esto posible a que los ácidos débiles no se disocian de forma completa, de modo que pueden actuar como dadores o aceptores de protones, por ejemplo cuando tenemos un aumento de la concentración en la disolución de H3O+, el tampón actúa como base y acepta protones. Cuando por el contrario aumenta en exceso de OH–, actúa como ácido y libera protones.
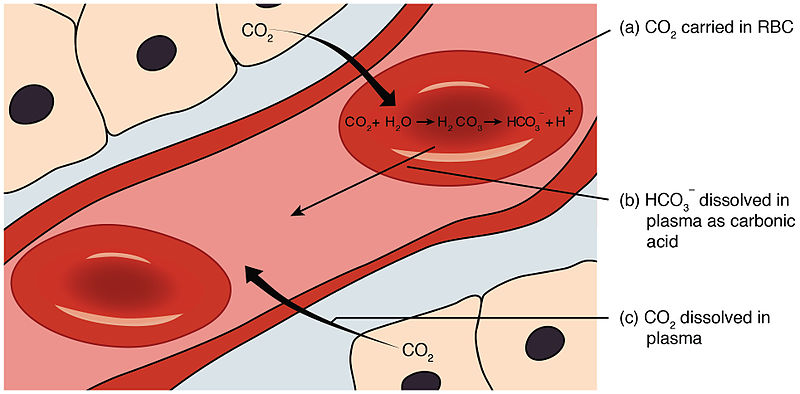
En los animales pulmonados, es sistema tampón carbonato-bicarbonato es una tampón fisiológico muy eficiente en valores cercanos pH 7,4 debido a que el plasma sanguíneo posee un equilibrio muy eficiente de reserva de CO2 contenido en los pulmones. En este sistema la reacción ácido-base queda de la siguiente forma:
HCO3– + H+ ↔ H2CO3 ↔ CO2 + H2O
Si aumenta la concentración de H+ en el medio por la adicción de productos metabólicos, el equilibrio se desplaza a la derecha, y se elimina al exterior del organismo el exceso de CO2 producido. Si por el contrario disminuye la concentración de H+ del medio, el equilibrio se desplaza a la izquierda, para lo cual se toma CO2 del medio exterior.
No basta con enseñar a conocer la Naturaleza,
debiéramos enseñar a amarla.
Fernando González Bernáldez
Ad orbis per scientiam